-
单晶培养、测试、解析...
2024.04.19南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2024.03.18南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2024.02.06南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.12.28南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.11.14南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.10.27南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.09.27南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.08.25南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.07.19南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.07.04南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.06.05南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.06.05南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.03.30南京晶立得科技有限公司 ......
-
单晶培养、测试、解析...
2023.03.06南京晶立得科技有限公司 ......
-
X 射线晶体衍射的应用
2022.03.04自从 20 世纪初,科学家 ......
-
X 射线晶体衍射的发展历程
2021.12.30一花一世界,一叶一菩提......
-
药物晶型简介
2021.10.17晶型是药物重要属性之一......
-
药物晶型筛选相关法规
2021.10.15药物晶型筛选,应以保证药......
-
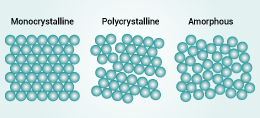
关于单晶 | 你想了解的都...
2021.10.13Q1:什么是晶体?......
药物晶型筛选相关法规
2021-10-15
药物晶型筛选,应以保证药品的有效性、安全性以及在质量可产生影响时,对原料药物、固体制剂、半固体制剂、混悬剂等进行定性或定量控制。
本文参考国内外药典,进行晶型筛选的相关法规、指导原则汇总。
一、 中国药典,2020 年版指导原则从以下几方面体现:
1. 药物多晶型的基本概念
2. 晶型样品的制备
(1)常用化学方法:重结晶法、快速溶剂去除法、沉淀法、种晶法等
(2)常物理方法:熔融结晶法、晶格物理破坏法、物理转晶法等
各种方法影响晶型物质形成的重要技术参数包括:溶剂(类型、组成、配比等)、浓度、成核速率、生长速率、温度、湿度、光度、压力、粒度等。
3. 晶型物质状态的稳定性
由于化合物晶型物质状态会随着环境条件变化(如:温度、湿度、光照、压力等),故需要对多晶型药物制剂进行晶型物质状态的稳定性进行研究。研究内容包括:原料药成分的晶型物质状态的稳定性,原料药晶型物质与制剂处方中各种辅料的相容性,制剂的制粒、成型、干燥等工艺对原料药晶型物质状态的影响等。
4. 晶型药物的生物学评价
5. 晶型药物的溶解性或溶出度评价
6. 药品晶型质量控制方法
(1)晶型种类鉴别——定性方法
方法 1 粉末X 射线衍射法(PXRD)
方法 2 红外光谱法(IR)
方法 3 拉曼光谱法(Raman)
方法 4 差示扫描量热法(DSC)
方法 5 热重法(TG)
方法 6 毛细管熔点法(MP)
方法 7 光学显微法(LM)
方法 8 偏光显微法(PM)
方法 9 固体核磁共振波谱法(ssNMR)
(2)晶型含量分析——定量方法
方法 1 单晶X 射线衍射法(SXRD)
方法 2 粉末X 射线衍射法(PXRD)
方法 3 差示扫描量热法(DSC)
方法 4 红外光谱(IR)
参考地址:https://www.chp.org.cn/gjyjw/tongze/5199.jhtml
1. 药物多晶型的基本概念
2. 晶型样品的制备
(1)常用化学方法:重结晶法、快速溶剂去除法、沉淀法、种晶法等
(2)常物理方法:熔融结晶法、晶格物理破坏法、物理转晶法等
各种方法影响晶型物质形成的重要技术参数包括:溶剂(类型、组成、配比等)、浓度、成核速率、生长速率、温度、湿度、光度、压力、粒度等。
3. 晶型物质状态的稳定性
由于化合物晶型物质状态会随着环境条件变化(如:温度、湿度、光照、压力等),故需要对多晶型药物制剂进行晶型物质状态的稳定性进行研究。研究内容包括:原料药成分的晶型物质状态的稳定性,原料药晶型物质与制剂处方中各种辅料的相容性,制剂的制粒、成型、干燥等工艺对原料药晶型物质状态的影响等。
4. 晶型药物的生物学评价
5. 晶型药物的溶解性或溶出度评价
6. 药品晶型质量控制方法
(1)晶型种类鉴别——定性方法
方法 1 粉末X 射线衍射法(PXRD)
方法 2 红外光谱法(IR)
方法 3 拉曼光谱法(Raman)
方法 4 差示扫描量热法(DSC)
方法 5 热重法(TG)
方法 6 毛细管熔点法(MP)
方法 7 光学显微法(LM)
方法 8 偏光显微法(PM)
方法 9 固体核磁共振波谱法(ssNMR)
(2)晶型含量分析——定量方法
方法 1 单晶X 射线衍射法(SXRD)
方法 2 粉末X 射线衍射法(PXRD)
方法 3 差示扫描量热法(DSC)
方法 4 红外光谱(IR)
参考地址:https://www.chp.org.cn/gjyjw/tongze/5199.jhtml
二、国外药典指导原则:
欧美等发达国家经过长期的研究和探索,较早就在药品注册管理中对药物多晶型制定了详细和科学的管理规范,包括人用药品注册技术国际协调会议 (ICH) 在 Q6A 部分就药物晶型的质量研究规范和要求制定了较系统的管理办法;欧洲药品管理局 (EMA) 以及美国食品药品监督管理局 (FDA) 则分别参照依照 ICHQ6A 的规范,对原料药和药品质量控制中的晶型问题也制定了相应规定,包括从药物研发、生产和管理的各个阶段注重固体药物晶型的问题。
此外,欧美药典很早就重视药物晶型检测标准的制定,收载的晶型药物品种也较同时期中国药典多,如 2015 年版《英国药典》中,“显示存在多晶型” 的品种有 195 个(但并非一定要制定晶型控制项目,只是提醒在制剂开发过程中需注意晶型问题);同样 2015 年生效的《欧洲药典》 8.0 版中,“显示存在多晶型”的则为 163 个品种;而在 2014 年《美国药典》 37 版,按“X-射线粉末衍射法”查询,共搜索到 23 个品种;按“结晶性”查询,共有 93 个品种,两者总和约为 116 个品种。
欧美等发达国家经过长期的研究和探索,较早就在药品注册管理中对药物多晶型制定了详细和科学的管理规范,包括人用药品注册技术国际协调会议 (ICH) 在 Q6A 部分就药物晶型的质量研究规范和要求制定了较系统的管理办法;欧洲药品管理局 (EMA) 以及美国食品药品监督管理局 (FDA) 则分别参照依照 ICHQ6A 的规范,对原料药和药品质量控制中的晶型问题也制定了相应规定,包括从药物研发、生产和管理的各个阶段注重固体药物晶型的问题。
此外,欧美药典很早就重视药物晶型检测标准的制定,收载的晶型药物品种也较同时期中国药典多,如 2015 年版《英国药典》中,“显示存在多晶型” 的品种有 195 个(但并非一定要制定晶型控制项目,只是提醒在制剂开发过程中需注意晶型问题);同样 2015 年生效的《欧洲药典》 8.0 版中,“显示存在多晶型”的则为 163 个品种;而在 2014 年《美国药典》 37 版,按“X-射线粉末衍射法”查询,共搜索到 23 个品种;按“结晶性”查询,共有 93 个品种,两者总和约为 116 个品种。

 025-86669819
025-86669819 2573477390
2573477390